Закрепление материала.
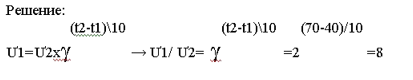
|
№ |
Основные пункты технологической карты |
Обязательная общая часть |
||||
|
1 |
Наименование дисциплины |
Химия |
||||
|
2 |
Тема урока |
Скорость химических реакций |
||||
|
3 |
Тип и вид занятия |
Комбинированный урок Повторение, лекция |
||||
|
4 |
Цели занятия (как ожидаемые результаты обучения) |
В результате проведённого урока учащиеся: продолжают формирование понятия «скорость химических реакций», выясняют, от каких факторов зависит скорость химических реакций; продолжают учиться обрабатывать и анализировать экспериментальные данные; выяснять взаимосвязь между скоростью химических реакций и внешними факторами; продолжают развитие коммуникативных умений в ходе парной и коллективной работы; акцентировать внимание на важности знаний о скорости химической реакции протекающих в быту (коррозия металла, прокисание молока, гниение и др.) закрепляют умение работать с электронным пособием, таблицами, справочным материалом, дополнительной литературой |
||||
|
5 |
Методы обучения |
Частично - поисковый (репродуктивный) |
||||
|
6 |
Формируемые компетенции (общие компетенции (ОК) и профессиональные компетенции (ПК)) |
Общие: формулировать свои ценностные ориентиры по отношению к изучаемым дисциплинам и сферам деятельности; уметь принимать решения, брать на себя ответственность за их последствия; осуществлять индивидуальную образовательную траекторию с учётом общих требований и норм; владеть разными видами речевой деятельности. Профессиональные: владеть навыками работы с различными источниками информации (электронное пособие, Интернет, словари, справочники, книги, учебники); самостоятельно искать, извлекать, анализировать и отбирать необходимую для решения учебных задач информацию; ориентироваться в информационных потоках, уметь осознанно воспринимать информацию; владеть навыками использования информационных устройств (ПК, принтер); применять для решения учебных задач информационные и телекоммуникационные технологии: аудио и видеозапись, электронную почту, Интернет; уметь применять на практике полученные знания. |
||||
|
7 |
Тезаурусное поле занятия |
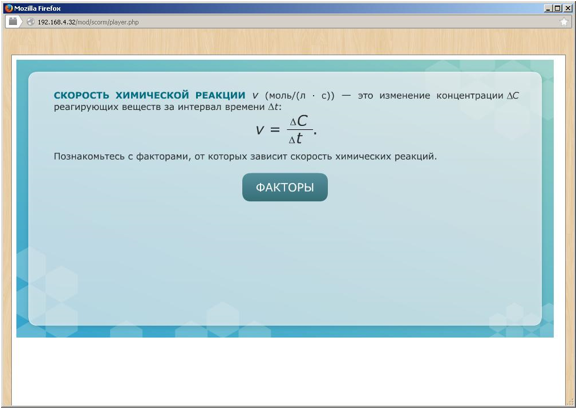
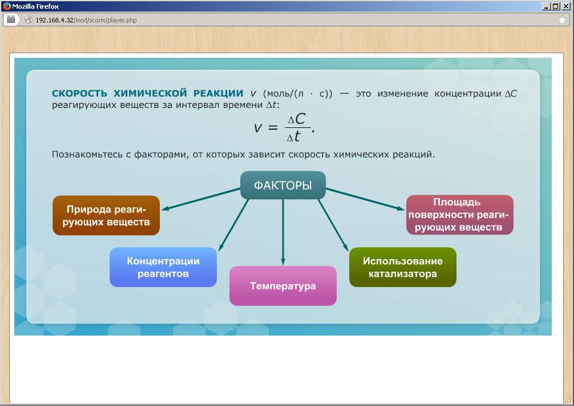
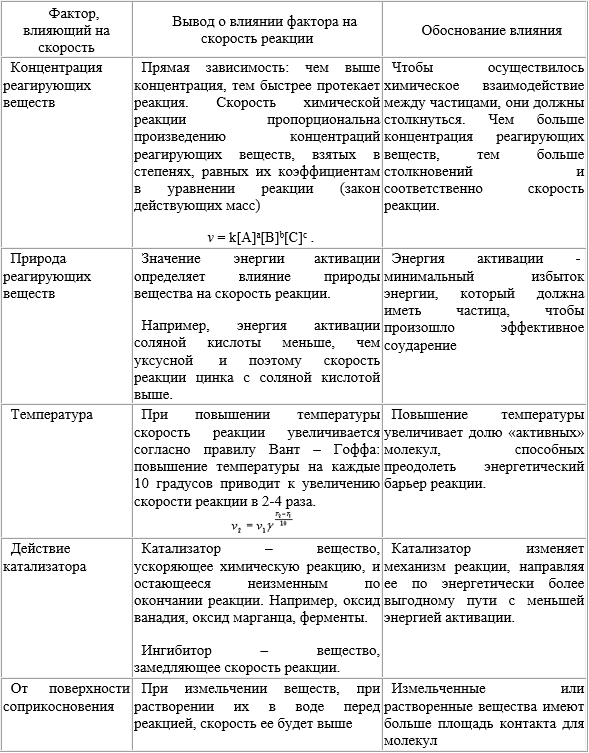
Химическая кинетика – раздел химии, в котором изучаются скорости и механизмы химических реакций. Система в химии – рассматриваемое вещество или совокупность веществ. Фаза - часть системы, которая отделена от других частей поверхностью раздела. Гомогенная (однородная) система – система, состоящая из одной фазы. Гетерогенная (неоднородная) система – система, состоящая из двух или нескольких фаз. Скорость гомогенной химической реакции – количество вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объёма системы. Скорость гетерогенной химической реакции – количество вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени на единице поверхности раздела фаз. Факторы, влияющие на скорость реакции: - природа реагирующих веществ; - концентрация реагирующих веществ; - температура; - присутствие катализаторов. Катализатор – вещество, которое изменяет (увеличивают) скорость реакции, но не расходуется в результате реакции. Ингибитор - вещество, которое изменяет (замедляют) скорость реакции, но не расходуется в результате реакции. Ферменты (энзимы) – биологические катализаторы. Закон действующих масс. |
||||
|
8 |
Используемые средства, в т.ч. средства ИКТ |
Компьютерный терминал, мультимедийный проектор, демонстрационный экран, ноутбук, колонки, 15 персональных компьютеров, диск с презентациями и показом опытов по гидролизу солей; основная и дополнительная литература |
||||
|
9 |
Междисциплинарные и межкурсовые связи |
Межпредметные: биология (химические реакции в живом организме), физика (понятие о тепловом эффекте реакций, влияние физических факторов на скорость химической реакции) |
||||
|
10 |
Образовательные ресурсы (в т. Ч. Интернет) |
Система электронного обучения «Академия-Медиа», химические сайты XuMuk.ru, Alhimik.ru, Полезная информация по химии, основная и дополнительная литература |
||||
|
|
Этапы занятия |
Длительность этапа |
Результаты |
Критерии и способ оценки |
Функция преподавателя |
Организация деятельности учащихся |
|
1 |
Организация начала занятия |
5 мин |
|
|
Приветствие Проверка подготовки студентов к занятию Готовность оборудования Запуск системы ЭО Определение отсутствующих студентов |
Приветствие Дежурный называет отсутствующих студентов |
|
2 |
Проверка домашнего задания |
10 мин |
|
|
Выдача карточек с индивидуальным заданием, вывод на экран заданий для всей группы |
Выполнение заданий, самопроверка и проверка в паре |
|
3 |
Этап подготовки студентов к активному и сознательному усвоению нового материала |
3 мин |
|
|
Объявление темы урока и определение его задач |
Запись темы в тетрадь Поиск соответствующей темы в системе ЭО |
|
4 |
Актуализация знаний, мотивационный этап |
12 мин |
|
|
Фронтальная беседа Постановка вопросов Управление дискуссией |
Ответы на вопросы, дополнение ответов друг друга |
|
5 |
Этап усвоения новых знаний |
20 мин |
|
|
Выдача заданий в электронном пособии, консультации |
Работа с электронным пособием |
|
6 |
Первичная проверка усвоения знаний |
10 мин |
|
|
Выдача заданий, контроль выполнения |
Выполнение заданий |
|
7 |
Первичное закрепление знаний |
15 мин |
|
|
Демонстрация опытов по теме с помощью проектора и экрана |
Наблюдение Составление уравнений реакций |
|
8 |
Контроль и самопроверка знаний. Рефлексивно-контролирующий этап |
7 мин |
|
|
Контроль написания уравнений, оценка, обобщение |
Самопроверка, выводы |
|
9 |
Подведение итогов занятия |
3 мин |
|
|
Проведение анализа успешности достижения цели занятия Оценка перспективы последующей работы |
|
|
10 |
Информация о домашнем задании, инструктаж по его выполнению |
5 мин |
|
|
Выдача домашнего задания Проведение инструктажа по его выполнению |
Запись домашнего задания, вопросы по его уточнению |