|
Ф.И.О. преподавателя |
Ефимова Валентина Владимировна |
|
Дата |
|
|
Группа |
|
|
Дисциплина |
Химия |
|
Тема |
Этиленовые углеводороды |
|
Тип урока |
Изучение нового материала |
|
Форма организации обучения |
Объяснительно-иллюстративный, репродуктивный, практический. |
|
Цели урока: |
|
|
Дидактическая |
– Расширить знания студентов об углеводородах – дать понятие о непредельных углеводородах и их классификации; познакомить с непредельными углеводородами этиленового ряда и его гомологами. |
|
Задачи: |
– Закрепить знания теории химического строения; |
|
Развивающая |
Формировать навыки познавательного мышления, развивать коммуникативные навыки. |
|
Задачи: |
Развивать способность слушать и выделять главное, сравнивать, обобщать изучаемые факты, делать выводы и применять полученные знания на практике |
|
Воспитательная |
Воспитание профессионально важных качеств личности. |
|
Задачи: |
Воспитывать трудолюбие, активность, аккуратность, внимательность, наблюдательность. |
|
Методы обучения: |
Информационный, проблемно-сообщающий, самостоятельная работа, объяснительно-иллюстративный, практический. |
|
Формы обучения: |
Фронтальная, индивидуальная. |
|
Средства обучения: Вербальные: |
Дидактический материал для закрепления знаний, таблица Компьютер, мультимедийный проектор, экран. |
|
Методы контроля |
Устный фронтальный опрос, письменная работа. |
|
Междисциплинарные связи |
Неорганическая химия |
|
Внутридисциплинарные связи |
Теория химического строения органических соединений, предельные углеводороды. |
|
Студент должен знать: |
– общую формулу алкенов; |
|
Студент должен уметь: |
– составлять структурные формулы алкенов; |
План-конспект открытого урока по теме «Этиленовые углеводороды»
1. Организационный момент. Приветствие, проверка отсутствующих
2. Целеполагание и мотивация. Сообщение темы, целей и задач урока, мотивации, что студенты должны знать и уметь, плана урока. (СЛАЙД).
Сегодня мы с вами изучим тему «Непредельные углеводороды». Изучение данной темы важно потому, что непредельные углеводороды находят в промышленности и в быту большое применение. Они являются важнейшими продуктами органического синтеза при производстве этилового спирта, полиэтилена, уксусной и пропионовой кислот, для синтеза каучука, пластических масс и лекарственных веществ. Поэтому целью сегодняшнего урока является расширить знания об углеводородах – дать понятие о непредельных углеводородах и их классификации; познакомить с непредельными углеводородами этиленового ряда и его гомологами.
Задачами являются: Закрепить знания теории химического строения;
– Формировать умения находить отличия в строении предельных углеводородов и непредельных углеводородов на примере метана и этилена;
– Обучить переносу знаний при ознакомлении студентов с гомологическим рядом этилена, видами изомерии;
– Дать первоначальные сведения о реакции полимеризации, получении и строении полимеров;
– области практического применения.
– Расширить понятие зависимости между строением, свойствами и применением веществ.
Студент должен знать:
– общую формулу алкенов; гомологический ряд и виды изомерии; их физические и химические свойства; области практического применения.
Студент должен уметь:
– составлять структурные формулы алкенов;
– называть их по систематической номенклатуре и по названию записывать формулы;
– составлять уравнения химических реакций, подтверждающих свойства этиленовых углеводородов и сравнивать их со свойствами предельных углеводородов;
– объяснять зависимость химических свойств алкенов от строения их молекул.
Для достижения данных целей мы должны изучить и познакомиться с составом и строением молекулы, номенклатурой и изомерией, физическими и химическими свойствами и применением этиленовых углеводородов. Работать будем в 4 командах.
3. Актуализация опорных знаний с помощью блиц-опроса.
Вопросы для актуализации знаний.
1-я команда
1. Какие соединения называются углеводородами?
2. Дайте определение предельным углеводородам. Какова их общая формула?
3. Какой тип гибридизации характерен для предельных углеводородов? Чему равняется угол между углерод – углеродными атомами в молекуле алканов?
2-я команда
4. Чему равняется длина связи в молекуле метана?
5. Какую геометрическую форму имеет молекула метана в пространстве?
6. Назовите предельные углеводороды по международной номенклатуре. (алканы)
3-я команда
7. Назовите исторически сохранившееся название предельных углеводородов.
8. Почему они называются парафинами? Что означает слово «парафины»?
9. Чем объясняется малая активность алканов? (Строением молекулы, так как в их молекулах имеется только ординарная связь: σ – связь).
4-я команда
10. Какие типы химических реакций характерны для алканов?
11. Каков механизм реакции замещения метана с хлором? (Цепной сводбоднорадикальный механизм)
12. Какие вещества называются изомерами и какой вид изомерии характерен для алканов?
4. Изучение нового материала по следующим вопросам:
4.1. Понятие о непредельных углеводородах и их классификация. СЛАЙД.
4.2. Состав и строение этиленовых углеводородов.
Студенты самостоятельно постараются дать определение алкенам по аналогии с алканами. Записывают определение.
Строение алкенов изучают по ММУ.
Вывод:
– Общая формула: СnH2n, наличие двойной связи в молекуле между атомами углерода;
– Тип гибридизации: sp2 - гибридизация;
– Строение молекулы: плоское;
– Угол между связями: 1200
– Длина связи: 0,134 нм;
– Нет свободного вращения, так как есть π – связь.
4.3. Гомологический ряд алкенов.
Раздать в группы дидактические карты и организовать работу по этим картам.
Гомологический ряд этиленовых углеводородов и их названия
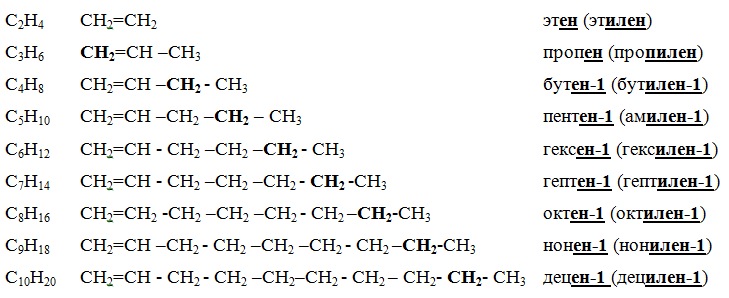 |
– В названии алкенов нумерация атомов углерода начинается с того конца, где ближе двойная связь.
– В названии вещества указывают атом углерода, от которого отходит двойная связь.
– Окончание –ан меняется на – ен.
Для алкенов существует 3 вида изомерии:
1. Структурная:
– Изомерия углеродного скелета;
– Изомерия положения двойной связи;
2. Межклассовая изомерия.
3. Пространственная изомерия.
4.5. Получение сегодня на уроке не будем изучать, вопрос остаётся вам на самостоятельное изучение. По способам получения этилена и изучению его свойств у нас будет лабораторное занятие.
4.6. Физические свойства. ММУ.
● С1 – С4 газы
● С5 – С18 жидкости
● С19 и выше твёрдые вещества
Не растворяются в воде, но растворяются в некоторых органических растворителях.
4.7. Химические свойства алкенов и их применение на основе этих свойств.
Выводы:
I. Реакции присоединения протекают по 2 механизмам: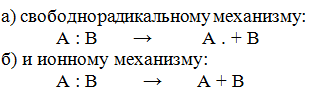
II. Реакции окисления.
III. Реакции полимеризации.
5. Обобщение и систематизация изучаемого материала. СЛАЙД.
Выводы студентов:
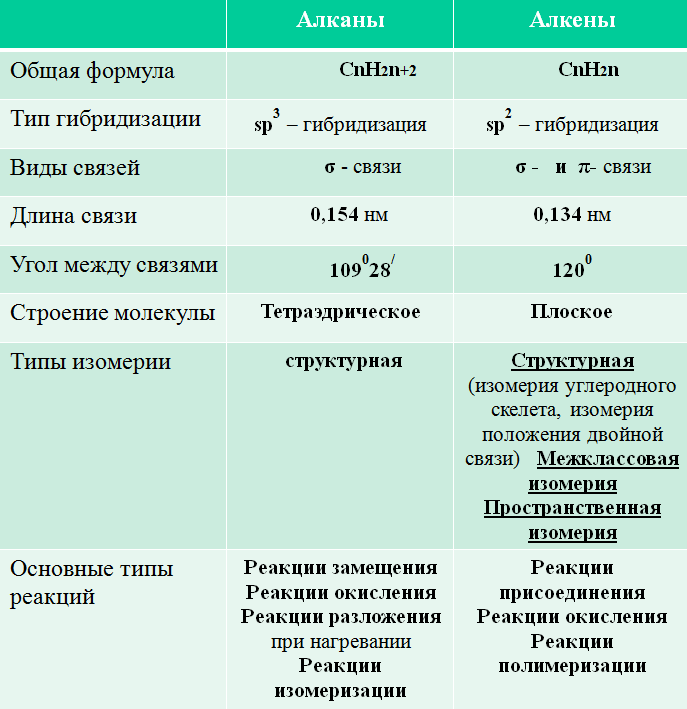
6. Выполнение упражнений на закрепление знаний.
Упражнения для закрепления знаний.
1. Назовите следующие соединения по современной международной номенклатуре:
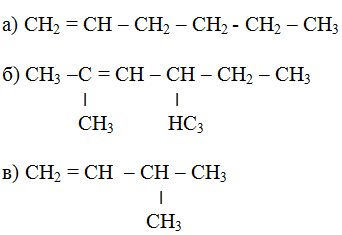
2. Напишите структурные формулы соединений по их названиям:
а) 3- метилпентен – 1;
б) 2,3 – диметилбутен – 1;
в) 2 – метил – 4 - этилгексен – 3.
3. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
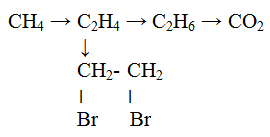
7. Итоги урока. Комментированная оценка знаний, выставление оценок в журнал.
Домашнее задание: упр.4,5 (с.294), получение алкенов (с.288) [1].
Тест по теме «Этиленовые углеводороды»
Вариант 1
|
№ вопроса |
Содержание вопроса |
Варианты ответов |
|
1. |
Какая из формул является общей формулой этиленовых углеводородов (алкенов)?
|
а) СпН2п+2 |
|
2. |
Укажите формулу гомолога этилена: |
а) СН3-СН2-СН3 |
|
3. |
Какая из формул соответствует названию 2 – метилпропен - 1? |
а) СН3-СН-СН3 б) СН3 - СН3 |
|
4. |
Какие типы химических реакций характерны для СН2=СН2? |
а) полимеризации, окисления и присоединения; |
|
5. |
Тип гибридизации в молекуле этилена: |
а)sр3 |
|
6. |
Какое из перечисленных веществ относится к алкенам? |
а) ацетилен |
|
7. |
Качественной реакцией на двойную связь является: |
а) обесцвечивание бромной воды и раствора перманганата калия; |
|
8. |
Определите продукт реакции в следующем уравнении и назовите его: |
а) пропан; |
Тест по теме « Этиленовые углеводороды»
Вариант 2
|
№ вопроса |
Содержание вопроса |
Варианты ответов |
|
1. |
Какая из формул является общей формулой алкенов? |
а) СпН2п |
|
2. |
Укажите формулу гомолога пропилена:
|
а) СН3-СН2-СН3 |
|
3. |
Какая из формул соответствует названию 2 – метилпентен - 1?
|
а) СН3-С = СН- СН2 -СН3 б) СН3 – СН=СН-СН2-СН3 |
|
4. |
Какие типы химических реакций характерны для СН2=СН-СН3? |
а) полимеризации, окисления и присоединения; |
|
5. |
Тип гибридизации в молекуле пропилена:
|
а) sр3 |
|
6. |
Какое из перечисленных веществ относится к алкенам?: |
а) ацетилен |
|
7. |
Качественной реакцией на двойную связь является: |
а) обесцвечивание бромной воды и раствора перманганата калия; |
|
8. |
Определите продукт реакции в следующем уравнении и назовите его: СН3 –СН2 - СН=СН2 + НСI→ |
а) бутан; |

