Цели урока:
- Образовательная: познакомить учащихся с одним из важнейших классов неорганических соединений, изучить классификацию и номенклатуру кислот.
- Развивающая: совершенствовать практические умения и навыки работы с лабораторным оборудованием и химическими реактивами; дополнить знания учащихся о правилах работы в химическом кабинете; развивать умение наблюдать, делать выводы.
- Воспитательная: продолжить формирование умения высказывать свои взгляды, суждения, развития химической речи; формировать мировоззренческие понятия о познаваемости природы.
Тип урока: урок формирования новых знаний.
Форма урока: урок - путешествие.
Методы и методические приемы: объяснительно-иллюстративные (рассказ с элементами беседы, демонстрация презентации), создание проблемной ситуации, практическая работа.
Предполагаемые результаты обучения:
- знать: понятие «кислота», формулы кислот, классификацию кислот, признаки действия кислот на индикаторы; правила ТБ при работе с кислотами.
- уметь: выбирать формулы кислот среди предложенных формул веществ, классифицировать кислоты по наличию кислорода, по числу атомов водорода, определять кислоту с помощью индикаторов, работать с растворами кислот, соблюдая правила техники безопасности.
Оборудование:
- компьютер, мультимедийный проектор, презентация Power Point;
- набор для практической работы учащихся: штатив с пробирками, индикаторы (лакмус, метиловый оранжевый, фенолфталеин), растворы кислот HCl, Н2SO4, лимонная кислота, сахар, лучина.
Ход урока
|
Деятельность учителя |
Деятельность ученика |
|
|
|
Из списка веществ выберите оксиды, основания и дайте им название: Al2O3, Cu(OH)2, H2SO4, Cl2O7, K2O, NaOH, HCl Почему не выписали формулы H2SO4 и HCl? Давайте расшифруем ребус и узнаем, что это за вещества, приложение 1. |
Выбирают оксиды, основания, дают названия.
Дают объяснение. Разгадывают ребус, формулируют тему урока. |
|
|
|
Итак, тема урока «Кислоты» Как вы думаете, что именно, мы будем сегодня изучать? Сегодня у нас урок – путешествие, во время которого мы совершим 4 остановки. 1 станция «Знакомство с жителями» Выписать формулы и названия кислот в тетрадь из информационного листа, составить формулы соответствующих оксидов, приложение 2. Сформулируйте, какие вещества называют кислотами? 2 станция «Экспериментальная» Если пробуешь на вкус Ты всё непременно, Может мальчик ты не трус, Но глупец отменный! Пробовать на вкус в лаборатории ничего нельзя, но как, же нам распознать кислоты? 1)Работа в парах (проведение эксперимента на изменение цвета метилового оранжевого, лакмуса и фенолфталеина в кислой среде), приложение 3. 2)Подготовленный ученик определяет кислоту с помощью рН – метра. 3)Визуально и с помощью таблицы растворимости опишите физические свойства кислот. 3 станция «Практическая» 1)Видеофрагмент «Правила работы с кислотами», цоры. 2)Демонстрация опыта «Обугливание лучины и сахара» 3)Видеофрагмент «Правила разбавления», цоры. 4 станция «Информационная» С помощью презентации, созданной в программе Smart Noot book разбирают классификацию кислот, распределяют формулы кислот в соответствии с группами. 1)Разделите кислоты по наличию кислорода в кислотном остатке 2)Разделите кислоты по количеству атомов водорода (по основности), приложение 4.
|
Записывают в тетрадь. Формулируют цели урока.
Выписывают формулы кислот, дают им названия в тетради, составляют формулы соответствующих оксидов. Кислоты – это сложные вещества, состоящие из иона водорода и кислотного остатка.
С помощью индикатора или рН – метра.
Проводят эксперимент, делают выводы.
Наблюдают через документ – камеру. Рассказывают о вкусе, цвете, агрегатном состоянии, по растворимости в воде.
Смотрят видеофрагменты и опыты.
Выполняют задания с доской Smart Noot book, делают записи в тетради. |
|
|
|
Тест по изученной теме, приложение 5. |
Выполнение теста |
|
|
|
Закончите одну из фраз: ü сегодня я узнал... ü было трудно… ü я понял, что… ü я научился… ü я смог… ü было интересно узнать, что… ü меня удивило… ü мне захотелось… |
Ученики устно заканчивают одну из фраз. |
|
|
|
§ 20, с 107 № 1,3,5 (а,б), кроссворд, приложение 6. Домашний эксперимент: выяснить, как влияет лимонная кислота на окраску сока свёклы и моркови. |
Записывают в дневник. |
Литература:
- Бочарова С.В. Химия 8 класс. Поурочные разработки. Волгоград, 2003.
- Габриелян О.С. Настольная книга для учителя химии. Химия. 8 класс. – М.: Дрофа, 1998.
- Габриелян О.С. Химия. 8класс. – М.: Дрофа, 2004.
- Денисова В.Г. Химия 8класс. Поурочные планы по учебнику О.С.Габриеляна. – Волгоград: Учитель, 2006. – 88 с.
- Единая коллекция цифровых образовательных ресурсов, http://school-collection.edu.ru/.
Приложение 1

Приложение 2
1 станция «Информационная»
Выпишите формулы кислот, подчеркните кислотные остатки. Указав степень окисления, напишите соответствующий оксид.
|
Формула кислоты |
Название кислоты |
Кислотный остаток |
Соответствующий оксид |
|
H2SO4 |
серная |
SO4 |
SO3 |
|
H2SO3 |
сернистая |
|
|
|
HNO3 |
азотная |
|
|
|
HNO2 |
азотистая |
|
|
|
H2CO3 |
угольная |
|
|
|
H2SiO3 |
кремниевая |
|
|
|
H3PO4 |
ортофосфорная |
|
|
|
HCl |
хлороводородная (соляная) |
|
|
|
H2S |
сероводородная |
|
|
|
HF |
фтороводородная (плавиковая) |
|
|
|
|
|
|
|
Приложение 3
2 станция «Экспериментальная»
- Налейте в две пробирки по 1 мл соляной и лимонной кислоты, затем в каждую добавьте 2-3 капли лакмуса, отметьте цвет растворов.
- Налейте в две пробирки по 1 мл соляной и лимонной кислоты, затем в каждую добавьте 2-3 капли метилоранжа, отметьте цвет растворов.
|
Название индикатора |
Окраска индикатора в воде |
Окраска индикатора в растворе соляной кислоты (HCl) |
Окраска индикатора в лимонной кислоте
|
|
Лакмус
|
фиолетовый
|
|
|
|
Метилоранж |
оранжевая
|
|
|
|
Фенолфталеин |
бесцветный |
|
|
Приложение 4


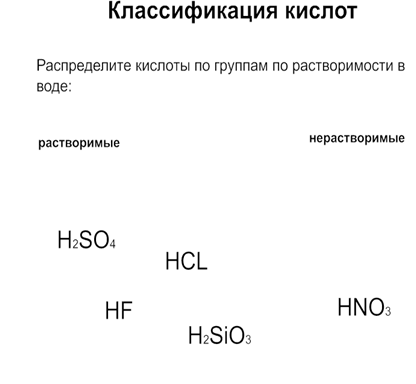
Приложение 5
Закрепляющий тест
Выберите только формулы кислот:
1)MgO, H2S,
2)Fe(OH)2, KCl,
3)H3PO4, CaO,
4)HF, H2SO4.
Выберите лишнюю формулу, объясните:
1)HCI, H3 PO4, H2CO3
2)H2SO3 ,HCI, H2 S
3)H2 SO4, НNO3, HNO2
Под действием раствора кислот лакмус становится:
1)Синим
2)Красным
3)Не изменяет окраску
4)Прозрачным
При разбавлении кислоты водой необходимо соблюдать правило:
1)Воду вливать в кислоту
2)Сливать одновременно
3)Кислоту вливать в воду
Какая кислота не растворяется в воде:
1)НNO3
2)H3 PO4
3)H2 S
4) H2SiO3