Урок химии сегодня – это не статическая форма организации учебного процесса, а вариативная и личностно-ориентированная деятельность учителя, направленная на развитие творческого системного мышления учащихся.
Как разнообразить урок? Какие методические приемы следует применять, чтобы материал, воспринимаемый учащимися во время урока, надолго оставался в памяти учеников? Эти вопросы, несомненно, волнуют каждого учителя, заинтересованного в повышении интереса учащихся к учебному материалу и в повышении качества обучения. Познавательные и практические задания, включенные в ход урока химии, будут способствовать лучшему усвоению знаний и формированию необходимых предметных умений и навыков.
При разработке урока по теме «Кислород: химический элемент и простое вещество. Получение и применение кислорода» мною использовались некоторые эвристические методы мышления / «Случайные предложения», «Телескоп и без него», «Метод моделирования маленькими человечками» /, которые будут содействовать активизации научного творчества восьмиклассников.
Я думаю, что необходимо включать в уроки творческие задания, которые непосредственно окажут влияние на умственное развитие учащихся, будут способствовать накоплению знаний и целенаправленному формированию у учащихся четкой системы понятий и закономерностей, свойственных определенным разделам химии.
Получение, химические свойства кислорода
Кислород – это вещество,
вокруг которого вращается земная химия.
вокруг которого вращается земная химия.
Я. Берцелиус
Цель: создание условий для усвоения темы: «Кислород: химический элемент и простое вещество. Получение и применение кислорода», развитие готовности мышления и усвоению новых способов деятельности, развитие мыслительных операций школьников, навыков самоконтроля; развитие информационной, коммуникативной компетентности учащихся.
Средства обучения:
интерактивная доска, схемы, таблицы, учебник, дополнительная литература, химический эксперимент, лабораторное оборудование.
Оборудование и реактивы:
компьютер, интерактивная доска, мультимедиа проектор, видео фрагменты из единой коллекции цифровых образовательных ресурсов, пробирки, штатив, лучинки, колбы, КMnO4 – перманганат калия.
1. Чудо. Мотивация
Начинаем урок с опыта получения кислорода нагреванием перманганата калия.
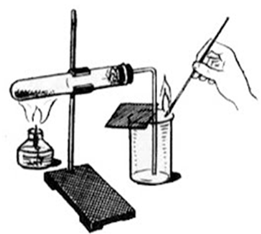 Рис. 1
Рис. 1В данном кроссворде зашифрован один элемент и одновременно вещество, разгадав его, мы попытаемся его определить и ответить на вопрос: «Какое вещество мы получили в начале урока? И что это за элемент?»:
Вопросы к кроссворду:
- Число атомов элементов в формуле. – ИНДЕКС.
- Наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. – ХИМИЯ.
- Свойство атомов химического элемента присоединять определенное число атомов других химических элементов. – ВАЛЕНТНОСТЬ.
- Русский ученый, один из основоположников атомно-молекулярного учения. – ЛОМОНОСОВ.
- То, из чего состоит физическое тело. – ВЕЩЕСТВО.
- Элемент, с порядковым номером 9, который имеет относительную массу 19. – ФТОР.
- Единица измерения количества вещества. – МОЛЬ.
- Первый элемент в ПСХЭ Д. И. Менделеева. – ВОДОРОД.
Рис. 2
В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно без …
Используя таблицу Д. И. Менделеева, заполните пустые места в схеме:
План-характеристика химического элемента:
- Символ – …
- Положение в ПСХЭМ – группа … , период… , порядковый номер – ….
- Химическая природа – неметалл.
- Относительная атомная масса – Ar (O) = …
- Валентность – ...
2. Вызов
Заметка в исторических газетах
- В 1758 году М. В. Ломоносов склонен был признать, что в процессе горения участвует воздух, и на основании своих опытов доказал, что в состав воздуха входит вещество, окисляющее металл.
- Упоминание об этом элементе вполне могло появиться уже в VIII в. Сведения о нем – косвенные, разумеется, – есть в трактате китайского алхимика Мао Хао. Китайцы знали «деятельное начало», входящее в состав воздуха, и называли его «йын». В XV в. следы кислорода можно обнаружить в трудах Леонардо да Винчи. Потом снова теряются – до XVII в., когда голландец Дреббель изобретает подводную лодку. Он использует селитру, чтобы ее кислородом обогатить воздух в подводной лодке. Но этот факт остался незамеченным.
- Одновременно с Пристли кислород открыл и шведский ученый Карл Шееле. Шееле даже получил его раньше, чем Пристли, но сообщение об этом было опубликовано позже, чем открытие Пристли. И все-таки главная фигура в истории открытия кислорода – не Шееле и не Пристли. Они открыли новый газ – и только. Собственно открывшим кислород остается французский химик Антуан Лавуазье. В 1775 году он исследовал кислород и создал кислородную теорию горения, которая пришла на смену теории флогистона (теория огненной материи). За два века, прошедшие со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась. Лавуазье дал название кислороду oxygenium – рождающий кислоту
- Открытие кислорода является одним из важнейших событий в истории, и связано с именами учёных Д. Пристли, К. Шееле и А. Лавуазье.
Вот как об этом писал сам Джозеф Пристли: «1 августа 1774 г. Я попытался извлечь воздух из ртутной окалины (оксида ртути) и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению».

Вопросы на понимание прочитанного:
- Восстановите в исторической последовательности вырезки из статей газет.
- Выпишите имена и фамилии ученых внесших вклад в открытие кислорода.
- Какое уравнение мы можем записать?
3. Литературная страничка:
А история простая…
Джозеф Пристли как-то раз
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета, без названья.
Ярче в нём свеча горит.
Новый газ из колбы вышел – никому он не знаком.
Этим газом дышат мыши под стеклянным колпаком,
Человек им тоже дышит.
Джозеф Пристли быстро пишет:
«Воздух делится на части»
Эта мысль весьма нова
Здесь у химика от счастья
Закружилась голова.
Вопросы на понимание прочитанного:
1) Необходимо сопоставить изображение маленьких человечков с таким понятием, как простое вещество и элемент «Кислород».
2) Составьте кластер «Физические свойства кислорода».
- 4. Составление схемы получения кислорода:
Для того чтобы выяснить, как можно получить кислород в лаборатории, как можно собрать его, и как этот газ обнаружить посмотрим опыт в «Видео сюжете».
1) Способ получения кислорода разложением перманганата калия при нагревании.
2KMnO4→ K2MnO4+MnO2+O2↑
2) Способ получения кислорода разложением пероксида водорода при наличии катализатора MnO2. Видео «Получение кислорода» http://www.youtube.com/watch?v=dbAqFbV4o5k
Катализаторы – это вещества, которые ускоряют ход химической реакции, но сами при этом не расходуются.
2Н2О2→2Н2О+ O2↑
3) Способ получения кислорода разложением хлората калия при наличии катализатора MnO2.
2KClO3→2KCl+ O2↑
4) Образование живыми растительными клетками органических веществ, таких, как сахара и крахмал, из неорганических – из СО2 и воды – с помощью энергии света, поглощаемого пигментами растений. Это процесс производства пищи, от которого зависят все живые существа – растения, животные и человек. У всех наземных растений и у большей части водных в ходе фотосинтеза выделяется кислород. Некоторым организмам, однако, свойственны другие виды фотосинтеза, проходящие без выделения кислорода. Главную реакцию фотосинтеза, идущего с выделением кислорода, можно записать в следующем виде: ВОДА + НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА + СВЕТ = ОРГАНИЧЕСКИЕ ВЕЩЕСТВА + КИСЛОРОД.
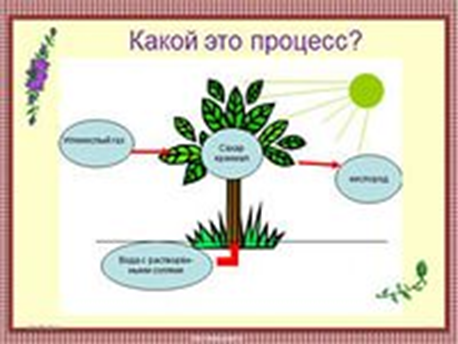

Рис. 4
Это процесс – фотосинтез. Используя фишки составить уравнение природного получения кислорода.
 5. Получение кислорода в промышленности. Из жидкого воздуха.
5. Получение кислорода в промышленности. Из жидкого воздуха.

 5. Получение кислорода в промышленности. Из жидкого воздуха.
5. Получение кислорода в промышленности. Из жидкого воздуха.
Рис. 5
4. Психологическая разгрузка
Уроки дыхательной гимнастики Стрельниковой – упражнение «Ладошки»
Исходное положение: станьте прямо, согните руки в локтях (локти вниз) и «покажите ладони зрителю» – «поза экстрасенса». Делайте шумные, короткие, ритмичные вдохи носом и одновременно сжимайте ладони в кулаки (хватательные движения). Подряд сделайте 4 резких, ритмичных вдоха носом (то есть «шмыгните» 4 раза). Затем руки опустите и отдохните 3–4 секунды – пауза; Сделайте еще 4 коротких, шумных вдоха и снова пауза. Это надо проделать 24 раза по 4 вдоха-движения. Всего – 96 вдохов-движений.
5. Игра-головоломка «Танграм»


Рис. 6
6. Как вы думаете, в каком виде кислород содержится в природе? Какие образует вещества? Аллотропия О – О2 – кислород и О3 – озон
|
Оно нам хорошо известно: |
Которое зовут озоном. |
|
Рис. 7 Найдите отличия в этих веществах. |
|
| 1. Вытеснением воды | 2. Вытеснением воздуха |

Рис. 8
7. Применение кислорода. В телескопи без него.
|
Что видим в телескопе |
На что смотрим |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
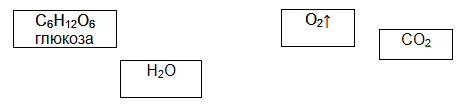
Случайные предложения. Перед тобой четыре пронумерованных слова:
1. Солнце. 2. Кислород. 3. Яблоки. 4. Вода. 5. Углекислый газ. 6. Глюкоза. 7. Клетка
Пойми, как построены следующие примеры.
Если 1+4+5, то «С помощью солнечного света, воды и углекислого газа образуется глюкоза.
А что будет в следующих примерах?
Если 2+4+7, то __________________________________________
Если 4+5, то ____________________________________________
Если 1+2+3+4, то ________________________________________
8. Работа на компьютере. Познавательный видеофильм «Кислород» http://planete-zemlya.ru/kakoj-zhe-byl-istochnik-kisloroda-na-zemle/
9. Резюме
Ссылки на источники
- Утёмов В. В., Зиновкина М. М. Структура креативного урока по развитию творческой личности учащихся в педагогической системе НФТМ-ТРИЗ // Концепт. – 2013. – Современные научные исследования. Выпуск 1. – ART 53572. – URL: http://e-koncept.ru/2013/53572.htm
- Утёмов В. В. Технология формирования креативного мышления на основе задач открытого типа // Вестник Сургутского государственного педагогического университета. – 2011. – № 3. – С. 51–57.
- Горев П.М., Утёмов В. В. Научное творчество: практическое руководство по развитию креативного мышления: Учебно-методическое пособие. – Книжный дом "ЛИБРОКОМ", 2014. – 112 с.
- Горев П.М., Утёмов В. В. Учимся вместе с Совёнком: эвристические методы мышления и активизации творчества // 2-е изд. – Киров : Изд-во ВятГГУ, 2012. – 112 с.
- Горев П.М., Утёмов В. В. Летнее путешествие с Совенком // Киров : Изд-во ВятГГУ, 2013. – 174 с.

